Endocrinologie
Publié le 16 aoû 2010Lecture 17 min
Ostéoporose de la femme non ménopausée : que faire ?
V. BREUIL, Service de rhumatologie, CHU de Nice
Avec l’avènement de l’ostéodensitométrie et la sensibilisation du public et des professionnels de santé à l’ostéoporose, nous sommes parfois confrontés à la prise en charge d’une ostéoporose, fracturaire et/ou densitométrique, survenant chez une femme non ménopausée. Il s’agit d’un sujet difficile car plus rare et moins bien codifié. Nous allons ici tenter de résumer les données actuelles disponibles sur la prise en charge de cette ostéoporose de la femme jeune : quelles sont les circonstances conduisant à évoquer le diagnostic ? Quelle enquête étiologique ? Que proposer en pratique lorsque cette enquête est négative ?
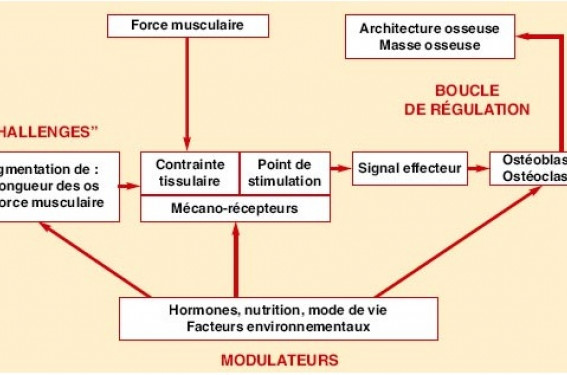
Rappelons qu’il n’existe pas une ostéoporose mais des ostéoporoses. Parmi elles, l’ostéoporose postménopausique est de loin la plus fréquente et, par conséquent, la mieux connue tant sur un plan épidémiologique que sur celui de la prise en charge diagnostique et thérapeutique. Les ostéoporoses secondaires, telles que l’ostéoporose cortisonique ou celle de l’hyperparathyroïdie, sont également de plus en plus étudiées. Mais d’autres causes d’ostéoporose préménopausique sont connues, notamment d’origine médicamenteuse. Définition et circonstances diagnostiques La survenue d’une fracture à faible traumatisme et/ou une impression de déminéralisation osseuse en radiographie standard (réalisée pour lombosciatique, traumatisme ou tendinopathie) sont les circonstances qui conduisent en général à la réalisation d’une mesure de la densité minérale osseuse chez une femme jeune. Notons également que cet examen peut parfois être réalisé chez des jeunes femmes ne présentant aucune symptomatologie, mais qui sont sensibilisées au problème de l’ostéoporose par une mère atteinte et/ou les médias. Notons que la mesure de la DMO est indiquée et remboursée, quels que soient l’âge et le sexe, si une fracture par fragilité survient (en dehors d’un contexte tumoral), ou en cas de pathologies potentiellement inductrices d’ostéoporose, en particulier les maladies endocriniennes et les traitements inducteurs de déminéralisation (corticoïdes, médicaments induisant une carence en stéroïdes sexuels). La définition OMS densitométrique de l’ostéoporose est basée sur des données épidémiologiques obtenues chez des femmes ménopausées. Peut-on l’appliquer à d’autres populations telles que les femmes non ménopausées ? Il n’y a pas de consensus réel. L’International Society for Clinical Densitometry (1) a proposé d’utiliser le Z-score plutôt que le T-score, mais ce point est actuellement débattu, et il est utile de souligner que dans la tranche d’âge considérée (> 25 ans), Z = T. La probabilité d’avoir un Z-score < -2 DS n’étant que de 2,5 %, il paraît justifier de considérer qu’un Z ou un T-score ≤ -2 DS est une situation anormale nécessitant une enquête étiologique. Épidémiologie et physiopathologie de la perte osseuse préménopausique La prévalence de l’ostéopénie et de l’ostéoporose chez la femme non ménopausée est à ce jour mal connue et les études épidémiologiques sont encore rares. Globalement, leur incidence est estimée à 0,4/100 000 personnes-année dans les deux sexes (2). Dans une étude réalisée en Thaïlande chez 1 935 femmes âgées de 40 à 80 ans (73 % ménopausées, âge moyen de la ménopause = 48 ans), utilisant comme seuil diagnostique un T-score < -2,5 DS, la prévalence est estimée à moins de 2 % d’ostéoporose chez les femmes non ménopausées, les données disponibles dans l’article ne permettant pas de déterminer la prévalence de l’ostéopénie dans cette même population (3). Dans une autre étude brésilienne, réalisée chez 60 femmes âgées de 40 à 50 ans, ayant des règles régulières, le Z-score lombaire était inférieur à -1 DS chez 23,3 % des femmes et le Z-score fémoral inférieur à -1 DS chez 40 % d’entre elles (4). Les ostéoporoses secondaires Le bilan initial de l’ostéoporose de la femme non ménopausée est primordial, car il permet de détecter fréquemment, comme dans l’ostéoporose masculine, une étiologie. Ainsi, dans une étude réalisée chez 111 femmes de moins de 55 ans adressées pour prise en charge d’une ostéoporose ou d’une ostéopénie (T-score < -2 DS) (5), les auteurs identifient une étiologie dans 66 % des cas (tableau). Dans une autre étude réalisée en Espagne chez 52 femmes ostéoporotiques (T-score < -2,5 DS rachis ou fémur) non ménopausées, âgées en moyenne de 36,2 ± 7 ans, 44 % des patientes avaient une ostéoporose secondaire, incluant syndrome de Cushing, grossesse et ostéogenèse imparfaite ; ces ostéoporoses secondaires étaient caractérisées par un indice de masse corporelle plus élevé et un Z-score plus bas que les formes idiopathiques (6). Le bilan initial de l’ostéoporose de la femme non ménopausée est primordial, car il permet de détecter fréquemment une étiologie. L’ostéoporose primitive de la femme jeune La physiopathologie de l’ostéoporose primitive de la femme jeune est encore mal connue, mais les auteurs s’accordent pour penser qu’elle fait intervenir soit un pic de masse osseuse bas, soit des facteurs environnementaux induisant une perte osseuse, soit une combinaison des deux. Les nombreuses études réalisées dans l’ostéoporose apportent de plus en plus d’arguments en faveur d’un déterminisme génétique important conditionnant à près de 85 % l’acquisition du pic de masse osseuse. Plusieurs gènes sont probablement impliqués, tels que le collagène de type I ou le promoteur de l’ostéoprotégérine, mais ces polymorphismes peuvent varier selon la population étudiée, justifiant la poursuite des études. Dans l’étude espagnole de P. Peris et coll. (6), des antécédents familiaux d’ostéoporose étaient retrouvés chez 48 % des patientes ayant une ostéoporose primitive préménopausique. Certains travaux ont montré qu’il existe une perte osseuse avant la ménopause, variable selon les sites : au rachis et à l’avant-bras, cette perte est évaluée à environ 1 % par an dans les études croisées, légèrement moins importante dans les études longitudinales, et est beaucoup plus faible à l’extrémité supérieure du fémur (7,8). Dans une étude récente réalisée sur une cohorte de 614 femmes âgées de 24 à 44 ans à l’inclusion et suivie pendant 6 ans, K.E. Bainbridge et coll. constatent pour le rachis lombaire des modifications variables selon l’âge, sans pouvoir déterminer un âge précis de début de perte osseuse, et une diminution de 1,6 % du Z-score au col à partir de 25 ans (9). D’autres facteurs environnementaux et de mode de vie jouent un rôle, tant dans l’acquisition du pic de masse osseuse que dans son maintien. Ainsi, le tabagisme, la consommation excessive d’alcool, l’exercice physique, l’état nutritionnel, les apports calciques et l’imprégnation estrogéniques apparaissent comme des facteurs conditionnant la densité minérale osseuse de la femme non ménopausée. L’exercice physique : un gage de bonne santé osseuse Dans une revue consacrée à « l’unité musculo-osseuse » chez l’enfant et l’adolescent, E. Schoenau et H.M. Frost(10) rappellent que la stimulation mécanique de l’os par l’exercice physique en charge joue un rôle primordial dans le renforcement de la résistance osseuse. En effet, les cellules osseuses sont sensibles à la stimulation mécanique, qui induit un signal augmentant la formation osseuse. Soulignons cependant que la physiologie de ce phénomène est complexe et reste encore mal connue à ce jour, bien que des travaux récents suggèrent que les estrogènes pourraient jouer un rôle important dans cet effet de stimulation mécanique de l’os. Par ailleurs, de nombreuses hormones et autres facteurs non mécaniques contribuant à cette résistance peuvent agir directement sur les cellules osseuses, mais aussi indirectement sur la force musculaire, par exemple l’hormone de croissance, les stéroïdes surrénaliens, les androgènes, le calcium, la vitamine D et ses métabolites (figure). Parallèlement, les études réalisées chez des femmes jeunes présentant une ostéoporose primitive confirment qu’elles ont une activité physique moindre que des femmes normales, en particulier à l’adolescence, période critique dans l’acquisition du pic de masse osseuse (4,11). Modèle fonctionnel du développement osseux selon la théorie du mécanostat. La pièce centrale de la régulation osseuse est la boucle de feed-back entre la déformation osseuse (contrainte tissulaire) et la résistance osseuse. Dʼaprès Schoenau E.(10) (2002). Les toxiques : tabac, alcool, café L’alcool, consommé modérément, pourrait être un facteur protecteur pour l’os, tandis que l’alcoolisme chronique est délétère, ses effets n’étant pas réversibles après l’arrêt de l’intoxication (12). S’il n’existe pas à ce jour de preuve formelle d’une association entre le tabagisme et la survenue de fractures, en revanche on sait que les femmes tabagiques sont plus maigres, qu’elles ont une moins bonne imprégnation estrogénique et que la diminution de la densité osseuse au col fémoral est corrélée au nombre de cigarettes consommée par jour ; la bonne nouvelle est que cette diminution est réversible à l’arrêt du tabac, une bonne raison de plus d’arrêter de fumer à l’heure de la campagne nationale de prévention du tabagisme (13). Enfin, la consommation excessive de caféine, qui diminue l’absorption digestive du calcium, est également un facteur de déminéralisation osseuse retrouvé dans certaines études (4). La diminution de la densité osseuse au col fémoral est corrélée au nombre de cigarettes consommée par jour. La diététique De nombreuses études ont mis en évidence un indice de masse corporelle significativement plus bas chez les femmes présentant une déminéralisation osseuse préménopausique, comparées à une population normale, de même que des apports calciques insuffisants (4,11). Si ce point est exposé brièvement, les études étant parfaitement concordantes, il n’en reste pas moins qu’il s’agit d’un facteur essentiel, souvent retrouvé et modifiable, d’où son importance lors de la prise en charge de nos patientes. Par ailleurs, les régimes trop riches en sodium, protéines ou sucres à métabolisme rapides sont une cause classique d’hypercalciurie ; cependant, le retentissement osseux de l’hypercalciurie reste encore mal connu, avec des résultats discordants dans la littérature, bien que certaines études aient rapporté une association entre hypercalciurie et diminution modérée de la densité minérale osseuse (14). L’imprégnation estrogénique L’imprégnation estrogénique apparaît aussi comme un facteur important dans l’acquisition et la préservation du pic de masse osseuse. À côté de l’aménorrhée caricaturale de l’anorexie mentale, une diminution infraclinique des taux circulants d’estrogènes semble également jouer un rôle. En effet, une élévation de la FSH > à 20 mui/l est associée à un haut niveau de remodelage (marqueurs biochi miques) et à une perte osseuse densitométrique progressive chez des femmes en péri-ménopause (15,16). D’autres indicateurs de mauvaise imprégnation estrogénique, tels que des oligoménorrhées ou des périodes d’aménorrhée transitoires, sont également retrouvés chez les patientes non ménopausées présentant une ostéoporose précoce, ainsi que la notion de puberté tardive (> 15 ans) (7,11). Enfin, bien que des cas d’ostéoporose induite par la grossesse aient été rapportés, ils restent heureusement rares. Si les modifications du métabolisme osseux pendant une grossesse normale sont encore mal compris, récemment une très belle étude réalisée chez 60 femmes suivies avant la conception et après l’accouchement a mis en évidence une perte osseuse à tous les sites de mesure, mais principalement au rachis, plus marquée en cas d’allaitement, avec, dans la grande majorité des cas, un retour à la normale un an après l’accouchement. À ce jour, l’impact du nombre de grossesses et de l’allaitement sur la densité minérale osseuse reste à préciser(17). En pratique, quel bilan ? L’interrogatoire et l’examen clinique devront rechercher des signes pouvant orienter vers une pathologie susceptible d’induire une ostéoporose, sans oublier les pathologies malignes et les causes médicamenteuses (gluco-corticoïdes, analogues de la GnRH ou de la LHRH, thyroxine, anticonvulsivants, héparine, anti-vitaminique K, lithium, chimiothérapies, méthotrexate, anti-protéases). La mesure de la densité minérale osseuse par absoptiométrie biphotonique à rayons X sera réalisée au col et au rachis, éventuellement au poignet si un des deux sites précédents est inutilisable (matériel d’ostéosynthèse, déformation, etc.). Une enquête diététique évaluera les apports calciques, caloriques, sodés et protéiques. Le bilan biologique comporte : NFS plaquettes, vitesse de sédimentation, C-réactive protéine, électrophorèse des protéines, bilan thyroïdien, calcémie, phosphorémie, créatininémie, 25 (OH) vitamine D, PTH, TGO, TGP, gamma GT, bilan martial (fer sérique, ferritine, coefficient de saturation du fer), calciurie des 24 heures, cortisolurie des 24 heures, marqueurs biologiques du remodelage, et un bilan hormonal (à réaliser dans les 5 premiers jours des règles) incluant FSH, LH estradiol, estrone. D’autres examens, plus spécialisés, pourront être réalisés en fonction du contexte clinique. Quelle prise en charge ? La prise en charge des ostéoporoses secondaires consiste principalement à traiter la cause, chaque fois que cela est possible, sans oublier d’associer les mesures d’hygiène de vie. Dans les ostéoporoses primitives de la femme jeune, on s’attachera à améliorer au maximum l’hygiène de vie : conseils diététiques avec optimisation des apports vitamino-calciques, correction des apports caloriques, sodés, et protéiques si nécessaire. On conseillera la pratique régulière d’un sport en charge, l’éviction du tabac et des excès d’alcool et de café, la correction d’une discrète carence estrogénique avec l’aide du gynécologue (18). Dans les ostéoporoses primitives de la femme jeune, on s’attachera à améliorer au maximum l’hygiène de vie. En dehors de ces mesures de bon sens, il n’existe pas à ce jour de prise en charge médicamenteuse codifiée de l’ostéoporose primitive de la femme jeune. Rappelons que les traitements antiostéoporotiques actuellement disponibles ont été validés uniquement chez la femme ménopausée. Que faire alors ? On pourra proposer dans un premier temps, surtout si l’ostéoporose n’est pas fracturaire, un suivi strict des mesures d’hygiène de vie et un contrôle densitométrique. En fonction de l’évolution clinique et densitométrique, de la survenue ou du caractère récidivant des fractures, ainsi que de l’angoisse de miques) et à une perte osseuse densitométrique progressive chez des femmes en péri-ménopause (15,16). D’autres indicateurs de mauvaise imprégnation estrogénique, tels que des oligoménorrhées ou des périodes d’aménorrhée transitoires, sont également retrouvés chez les patientes non ménopausées présentant une ostéoporose précoce, ainsi que la notion de puberté tardive (> 15 ans) (7,11). Enfin, bien que des cas d’ostéoporose induite par la grossesse aient été rapportés, ils restent heureusement rares. Si les modifications du métabolisme osseux pendant une grossesse normale sont encore mal compris, récemment une très belle étude réalisée chez 60 femmes suivies avant la conception et après l’accouchement a mis en évidence une perte osseuse à tous les sites de mesure, mais principalement au rachis, plus marquée en cas d’allaitement, avec, dans la grande majorité des cas, un retour à la normale un an après l’accouchement. À ce jour, l’impact du nombre de grossesses et de l’allaitement sur la densité minérale osseuse reste à préciser (17). En pratique, quel bilan ? L’interrogatoire et l’examen clinique devront rechercher des signes pouvant orienter vers une pathologie susceptible d’induire une ostéoporose, sans oublier les pathologies malignes et les causes médicamenteuses (gluco-corticoïdes, analogues de la GnRH ou de la LHRH, thyroxine, anticonvulsivants, héparine, anti-vitaminique K, lithium, chimiothérapies, méthotrexate, anti-protéases). La mesure de la densité minérale osseuse par absoptiométrie biphotonique à rayons X sera réalisée au col et au rachis, éventuellement au poignet si un des deux sites précédents est inutilisable (matériel d’ostéosynthèse, déformation, etc.). Une enquête diététique évaluera les apports calciques, caloriques, sodés et protéiques. Le bilan biologique comporte : NFS plaquettes, vitesse de sédimentation, C-réactive protéine, électrophorèse des protéines, bilan thyroïdien, calcémie, phosphorémie, créatininémie, 25 (OH) vitamine D, PTH, TGO, TGP, gamma GT, bilan martial (fer sérique, ferritine, coefficient de saturation du fer), calciurie des 24 heures, cortisolurie des 24 heures, marqueurs biologiques du remodelage, et un bilan hormonal (à réaliser dans les 5 premiers jours des règles) incluant FSH, LH estradiol, estrone. D’autres examens, plus spécialisés, pourront être réalisés en fonction du contexte clinique. Quelle prise en charge ? La prise en charge des ostéoporoses secondaires consiste principalement à traiter la cause, chaque fois que cela est possible, sans oublier d’associer les mesures d’hygiène de vie. Dans les ostéoporoses primitives de la femme jeune, on s’attachera à améliorer au maximum l’hygiène de vie : conseils diététiques avec optimisation des apports vitamino-calciques, correction des apports caloriques, sodés, et protéiques si nécessaire. On conseillera la pratique régulière d’un sport en charge, l’éviction du tabac et des excès d’alcool et de café, la correction d’une discrète carence estrogénique avec l’aide du gynécologue (18). Dans les ostéoporoses primitives de la femme jeune, on s’attachera à améliorer au maximum l’hygiène de vie. En dehors de ces mesures de bon sens, il n’existe pas à ce jour de prise en charge médicamenteuse codifiée de l’ostéoporose primitive de la femme jeune. Rappelons que les traitements antiostéoporotiques actuellement disponibles ont été validés uniquement chez la femme ménopausée. Que faire alors ? On pourra proposer dans un premier temps, surtout si l’ostéoporose n’est pas fracturaire, un suivi strict des mesures d’hygiène de vie et un contrôle densitométrique. En fonction de l’évolution clinique et densitométrique, de la survenue ou du caractère récidivant des fractures, ainsi que de l’angoisse de la patiente, on pourra discuter au cas par cas l’utilisation des bisphosphonates, qui ont déjà prouvé leur efficacité dans la prise en charge d’autres types d’ostéoporoses survenant chez l’enfant ou le sujet jeune, tel que l’ostéogenèse imparfaite. Néanmoins, dans ces cas exceptionnels, il est indispensable d’informer la patiente des risques mal connus des bisphosphonates pour une éventuelle grossesse. La conception doit être contre-indiquée pendant l’administration de ces traitements et on doit privilégier les molécules à clairance rapide à l’arrêt du traitement (risédronate). Il n’y a actuellement pas de données disponibles concernant le ranélate de strontium. Il est indispensable d’informer la patiente des risques mal connus des bisphosphonates pour une éventuelle grossesse. En pratique L’ostéoporose de la femme jeune reste encore à ce jour, en dehors des ostéoporoses secondaires, une entité mal connue. Sa physiopathologie fait probablement intervenir de manière intriquée des facteurs génétiques et des facteurs environnementaux. Le Z-score doit être utilisé pour apprécier le degré de déminéralisation. Un bilan étiologique initial complet est indispensable, car les patientes présentant une cause d’ostéoporose secondaire identifiée pourront bénéficier d’un traitement adapté. Quant à l’ostéoporose primitive de la femme jeune, sa prise en charge est encore mal définie et repose principalement sur des mesures d’hygiène de vie et sur la correction de facteurs de risque. De nouvelles études apparaissent indispensables pour mieux comprendre cette entité et préciser sa prise en charge.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :






