Publié le 05 sep 2006Lecture 11 min
OPK : quand faut-il passer en FIV ?
P. Merviel, S. Najas, H. Campy, F. Brasseur , S. Floret
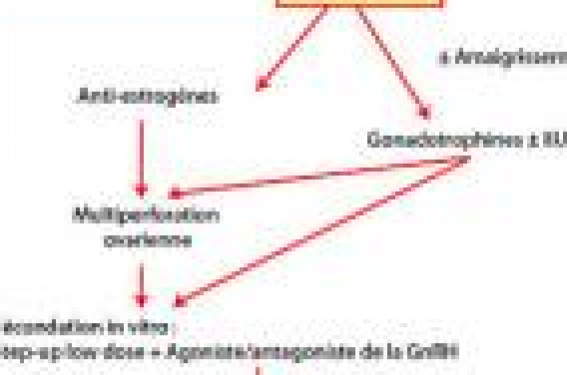
La fécondation in vitro (FIV) n’est indiquée qu’en cas d’échec des traitements inducteurs, de réponses multifolliculaires à répétition ayant nécessité plusieurs arrêts en cours de stimulation, ou s’il existe d’emblée des facteurs tubaires et/ou masculins associés.
Décrit initialement par Stein et Leventhal en 1935, le syndrome des ovaires polykystiques (SOPK) associe une anovulation ou des irrégularités menstruelles, un hirsutisme, une obésité et des ovaires macroscopiquement et histologiquement polykystiques. Le SOPK est considéré comme la plus fréquente des endocrinopathies de la jeune femme en période d’activité génitale (prévalence d’environ 6 %)(1), et comme la première cause d’anovulation et d’hirsutisme. Les différentes formes pathologiques du SOPK sont regroupées autour de perturbations s’auto-entretenant et comprenant une sécrétion gonadotrope inappropriée, une hyperandrogénie d’origine ovarienne avec production estrogénique excessive et une multifolliculogenèse évoluant spontanément vers l’atrésie. En cas de désir de grossesse chez une femme présentant un SOPK avec anovulation, la première étape consiste à explorer complètement le couple (perméabilité tubaire, qualité du sperme). En l’absence de facteurs associés d’infertilité, la stimulation de l’ovulation constitue le traitement symptomatique habituel, puisqu’il n’existe pas pour l’instant de traitement étiologique en dehors de certaines formes secondaires comme les blocs enzymatiques en 21 hydroxylase. Rappels physiopathologiques et traitements inducteurs des OPK(2) En cycle spontané Chez les patientes atteintes d’OPK, après recrutement de plusieurs petits follicules, la croissance folliculaire initialement normale tend à s’arrêter au-delà de 10 mm. Aucun follicule dominant n’est sélectionné et l’évolution se fait typiquement vers l’atrésie et l’accumulation sous forme de microkystes. Sous stimulation ovarienne Les réponses sont caractérisées par une hypersensibilité aux gonadotrophines exogènes avec recrutement d’un nombre anormalement élevé de follicules (plus de 10 à 15 sur chaque ovaire). Ces follicules restent longtemps de petite taille et ont un développement asynchrone (dissociation hormono-morphologique). Certains évoluent vers l’atrésie ou un état kystique, les autres augmentent progressivement de taille, mais atteignent difficilement le diamètre pré-ovulatoire de 18-20 mm. En fécondation in vitro La ponction permet habituellement de recueillir des ovocytes nombreux, mais plus ou moins immatures dont le taux de fécondation est souvent inférieur à la normale (50 à 60 %). Ce défaut de maturation contraste avec une stéroïdogenèse conservée puisque l’estradiol plasmatique s’élève de façon rapide en fin de stimulation pour atteindre des niveaux souvent très élevés. Ce type de réponse explosive constitue un facteur de risque majeur d’hyperstimulation clinique et/ou de grossesses multiples. Deux éléments semblent néanmoins plus déterminants dans l’efficacité de la prise en charge de l’infertilité et la naissance d’enfants vivants : le degré de l’hyperinsulinisme et la concentration de LH circulante. Dans un premier temps, il faudra toujours conseiller un amaigrissement à la patiente. Les traitements inducteurs Ils se distinguent par leur mode d’action : les uns ont pour but de stimuler les gonadotrophines endogènes : citrate de clomifène et administration pulsatile de GnRH ; les autres font appel aux gonadotrophines exogènes, hMG et FSH. > Les anti-estrogènes (Clomid“) Ils permettent d’obtenir une ovulation chez 70-85 % des patientes et une grossesse chez 40 à 50 % d’entre elles. Certains auteurs ont relié le faible taux relatif de grossesses à l’existence d’une insuffisance lutéale et d’un appauvrissement de la glaire. Le risque de fausse couche spontanée (FCS) ne serait élevé que chez les patientes dont la LH plasmatique est augmentée immédiatement après le traitement. Parmi les échecs du citrate de clomifène, il faut distinguer : – les ovulations obtenues sans grossesse, qui incitent à poursuivre le traitement au moins 6 cycles, sans dépasser 12 cycles du fait de l’augmentation théorique du risque de cancer de l’ovaire ; – et les absences d’ovulation malgré une augmentation suffisante des doses, qui conduisent à proposer plus rapidement une autre modalité thérapeutique. > Les gonadotrophines exogènes (hMG), FSH urinaire (Fostimon®), FSH recombinante (Gonal-F®, Puregon®) Elles sont indiquées dans les cas d’OPK résistants au citrate de clomifène (15 à 30 % des cas), avec plusieurs schémas d’administration possibles. Dans les études les plus récentes, on obtient de 83 à 95 % d’ovulations avec un taux cumulatif de grossesses de 58 à 72 % avec les gonadotrophines, sans amélioration en termes de réponse mono- ou pauci-folliculaire avec les FSH urinaires ou recombinantes. > La pompe à GnRH (Lutrelef®) Le but de ce traitement est d’imposer un rythme physiologique de GnRH (1 pulse toutes les 60 à 90 minutes) à la place d’une sécrétion anarchique hypertonique de LH chez les femmes ayant des OPK. Les traitements chirurgicaux Ils se discutent pour les OPK résistant au citrate de clomifène et difficiles à stimuler, notamment avec antécédents d’hyperstimulation ovarienne. Les multiperforations ovariennes ou drilling se déroulent par cœlioscopie ou fertiloscopie, et permettent souvent de restaurer une ovulation physiologique, sans nécessité d’un monitorage intensif(3). De façon spontanée ou en association avec des gonadotrophines, des taux d’ovulations et de grossesses équivalents à ceux des traitements médicaux peuvent être obtenus, avec plutôt moins de FCS : de 13 à 21 % selon les études. Les mécanismes d’action de ces méthodes restent mal compris : réduction de la taille des ovaires, augmentation de la FSH endogène et, surtout, baisse rapide des taux d’androgènes et de LH plasmatiques, étroitement corrélée à la survenue des grossesses et à la réduction du taux de FCS. Place de la fécondation in vitro en cas d’OPK Quand passer à la FIV ? Certaines circonstances conduisent à proposer une prise en charge en fécondation in vitro chez les femmes présentant des OPK : • Stérilité persistante inexpliquée, malgré une ovulation de bonne qualité. • Impossibilité d’obtenir une stimulation mono- ou pauci-folliculaire, exposant la patiente au risque d’une grossesse multiple. • Absence d’ovulation malgré antiestrogènes et gonadotrophines. • Absence d’amélioration de la qualité de la folliculogenèse après multiperforation ovarienne ± stimulation. • Existence d’une cause associée d’infertilité, tubaire ou masculine, rendant nécessaire une prise en charge en FIV/ICSI. Comment ? La FIV nécessite des stimulations fortes, avec la possibilité, dans le cas des OPK, de risque d’hyperstimulation ovarienne. Logiquement, on tend donc à diminuer la quantité d’unités de FSH ou d’hMG prescrites, mais on sait que l’intervalle entre une réponse folliculaire excessive et une atrésie folliculaire est souvent étroit. Les caractéristiques des stimulations ovariennes chez ces patientes sont particulières, avec un seuil de réactivité à la FSH abaissé, une réponse plurifolliculaire forte associée à un taux de 17 ß estradiol élevé. Le recueil ovocytaire et la production embryonnaire, les taux d’implantations et les taux de grossesses restent bons, mais les risques sont les grossesses multiples et les hyperstimulations ovariennes. Pour quels résultats ? Bien que l’analyse de la littérature montre que les résultats en FIV des patientes ayant des ovaires polykystiques sont globalement bons et comparables aux autres causes d’infertilité (tubaire ou masculine), il persiste certains problèmes chez ces femmes, comme le surpoids et l’insulinorésistance, l’atrésie folliculaire et la difficulté à déterminer le bon seuil de FSH pour obtenir une réponse folliculaire mature et homogène. En effet, il faut distinguer les femmes présentant des ovaires polykystiques isolés sans syndrome endocrino-métabolique et celles ayant un syndrome des ovaires polykystiques avec anomalies métaboliques, où les résultats sont parfois bien inférieurs dans certaines séries. Figure 2. Vue cœlioscopique d’ovaires polykystiques Quelles gonadotrophines ? Des métaanalyses ont été réalisées dans le cadre de l’induction de l’ovulation et en FIV, montrant qu’il n’existe pas de différence dans le cas des OPK entre les FSH urinaires ou recombinantes et les hMG, contrairement à ce que pourrait laisser croire la présence de LH dans la composition des hMG (chez des femmes qui présentent déjà un excès de LH…). La dose de départ doit toujours être prudente, entre 50 et 150 unités par jour. Quel protocole de stimulation ? Différents protocoles d’administration des gonadotrophines ont été utilisés dans le cadre des OPK. > Protocole step-up/low-dose C’est de loin le meilleur protocole dans le cas des OPK, utilisant le principe du seuil de FSH permettant une réponse folliculaire suffisante sans être excessive (diminution du risque d’hyperstimulation ovarienne). > Protocole step-down Protocole alternatif au précédent dans ce cas, où le principe est l’utilisation de la fenêtre de FSH en début de phase folliculaire. L’objectif est de dépasser initialement le seuil de sensibilité ovarienne à FSH pendant 3-4 jours pour obtenir un recrutement folliculaire, puis de réduire les doses afin de permettre une certaine sélection folliculaire. Les agonistes de la GnRH (Décapeptyl®) Ils ont été proposés dans le but de supprimer l’hypertonie de la LH, facteur supposé de réduction du taux de grossesses et d’augmentation des fausses-couches. Cependant, cet éventuel effet bénéfique sur les fausses-couches n’a pas été retrouvé dans les dernières études(4). Les réponses sous agonistes du GnRH sont généralement multifolliculaires et les ovocytes nombreux, mais de qualité inégale. Une double suppression par contraceptif oral et agoniste du GnRH serait susceptible d’améliorer les résultats chez ces patientes (protocole type « Rozenwacks »). Les antagonistes de la GnRH (Cetrotide®, Orgalutran®) L’utilisation des antagonistes de la GnRH dans le cadre du syndrome des ovaires micropolykystiques (OPK) paraît être intéressante, mais le coût du traitement risque d’être élevé car dans ce cadre, un protocole de stimulation dit low-dose est souvent utilisé. On pourrait alors imaginer que le début du Cétrotide® soit fonction de l’échographie folliculaire et de l’estradiolémie plasmatique, ce qui est moins simple. Dans le cas des OPK, une étude menée par Dubourdieu et Bouchard en 1993(5) a permis de supprimer la sécrétion inappropriée de LH par un antagoniste de la GnRH chez deux patientes résistantes au citrate de clomifène. Cependant, malgré la restauration d’une pulsatilité normale de la GnRH, l’estradiolémie est restée inférieure à 50 pg/ml, sans développement folliculaire, ni ovulation, constatations qui ont surtout permis de confirmer l’origine ovarienne de cette maladie. De Jong a publié en 1998(6) le cas d’une femme de 33 ans, stimulée en vue d’une FIV par 150 UI de recombinante FSH à partir du 2e jour du cycle associé à du ganirelix 0,125 mg à partir du 7e. Au 10e jour, l’estradiol était à 4 556 pg/ml avec 4 follicules supérieurs à 16 mm et 9 entre 10 et 16 mm. L’augmentation de la dose de ganirelix et l’arrêt de la FSH recombinante a permis une chute rapide de l’estradiolémie et une réduction de la taille ovarienne à l’échographie, stratégie qui pourrait être également intéressante en cas de réponse multifolliculaire hors FIV, reproduisant un effet « coasting » permettant d’obtenir une atrésie folliculaire partielle et bloquant la survenue d’un pic de LH. Dans la métaanalyse de la Cochrane Database(7), le risque d’hyperstimulation ovarienne sévère est significativement diminué d’un facteur 3 avec l’utilisation des antagonistes de la GnRH, à niveau égal de stimulation. On note néanmoins une diminution des taux de grossesses. Malgré cela, l’utilisation des antagonistes de la GnRH paraît fortement indiquée dans ce groupe car elle entraîne une diminution des follicules secondaires et la possibilité de déclencher par un agoniste de la GnRH (dose unique de triptoréline 0,2 mg ou de leuproréline 0,5 mg). Figure 3. Échographie d’ovaires polykystiques : signe du collier des follicules et hypertrophie du stroma ovarien. La metformine (Glucophage®) Elle sensibilise les tissus périphériques aux effets de l’insuline et réduit ainsi l’insulinorésistance, l’hyperinsulinisme et l’hyperandrogénie, et améliore l’ovulation spontanée ou stimulée par citrate de clomifène. L’utilisation de la metformine en FIV donne des résultats contradictoires avec soit une amélioration des taux de grossesses cliniques (70 % versus 30 % des cas(8)), soit une absence de bénéfice de ce traitement(9), sauf peut-être chez les patientes maigres paradoxalement. Conclusion La FIV n’est indiquée qu’en cas d’échec des traitements inducteurs, de réponses multifolliculaires à répétition ayant nécessité plusieurs arrêts en cours de stimulation, ou s’il existe d’emblée des facteurs tubaires et/ou masculins associés. Le prélèvement d’ovocytes immatures en cycle spontané et leur maturation in vitro (MIV) donne des résultats encourageants et permet d’éviter tout risque d’hyperstimulation ovarienne(10).
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :




