Publié le 12 déc 2007Lecture 8 min
Môles hydatiformes et tumeurs trophoblastiques : du diagnostic au traitement
J. MASSARDIER, F. GOLFIER, D. BENAYOUN, D. RAUDRANT Service de Gynécologie Obstétrique, Hôtel Dieu, Lyon Centre de Référence des Maladies Trophoblastiques, Lyon
Les pathologies môlaires représentent des entités différentes souvent mal connues des cliniciens.
Leur pronostic est excellent, sous réserve d’une prise en charge adaptée. Nous rappelons les modalités diagnostiques et de prise en charge des grossesses môlaires, les critères diagnostiques des tumeurs trophoblastiques gestationnelles et la conduite à tenir au sein du Centre de Référence des Maladies Trophoblastiques de Lyon.
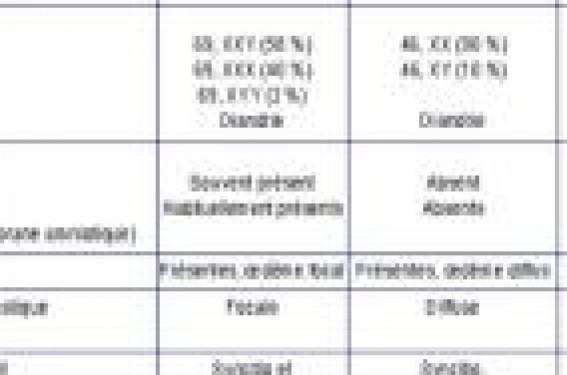
Généralités Les maladies trophoblastiques gestationnelles regroupent un ensemble de pathologies tumorales reliées entre elles et dérivant toutes de tissu trophoblastique placentaire. Il existe souvent une confusion dans les dénominations employées. L’OMS a proposé en 2003 une classification des maladies trophoblastiques en plusieurs types : – les môles hydatiformes regroupant les môles complètes (MC) et les môles partielles (MP) ; – les môles invasives, – les choriocarcinomes, – les tumeurs trophoblastiques du site placentaire, – les lésions trophoblastiques diverses. Cette classification est basée sur des critères macroscopiques : gonflement des villosités choriales sans ou avec des éléments embryonnaires, ou tumeur trophoblastique sans villosités. La FIGO a proposé une stadification en 2000 pour ce que l’on appelait auparavant les maladies trophoblastiques gestationnelles persistantes. Le terme adéquat est maintenant « Tumeur Trophoblastique Gestationnelle (TTG) ». Le diagnostic, qui peut faire suite à une môle partielle ou complète, est basé sur l’évolution anormale du taux d’hCG après évacuation du tissu môlaire. Ce diagnostic de TTG n’inclut pas directement les môles partielles ou complètes. Les choriocarcinomes sont obligatoirement considérés d’emblée comme des TTG. Le tableau 1 résume les caractéristiques histologiques et génétiques. Le dénominateur commun des maladies trophoblastiques est la prolifération excessive de trophoblaste. Épidémiologie Les données épidémiologiques ne sont pas toujours concordantes suivant les publications entre et au sein des mêmes populations. Il ressort cependant que l’incidence des pathologies môlaires varie fortement suivant les pays. L’incidence des MC est estimée en Europe et en Amérique du Nord à 0,5 à 1/1 000 grossesses. Cette incidence est deux fois plus importante au Japon et en Chine (1 à 2/1 000 grossesses). Des pays comme les Philippines, l’Inde ou la Turquie rapportent des incidences jusqu’à 12/1 000 grossesses. L’incidence de la pathologie môlaire semble diminuer de façon générale depuis 30 ans. L’incidence des TTG est estimée à 0,2 à 0,5 pour 1 000 grossesses en Europe et en Amérique du Nord, 1,2/1 000 grossesses au Japon et jusqu’à 19/1 000 grossesses en Inde. Les facteurs de risque ne sont pas clairement identifiés, tant pour la survenue d’une grossesse môlaire que pour l’évolution vers une TTG. Le rôle de l’empreinte parentale semble déterminant. Le risque de récidive est estimé à 1 % après une MC. Le pronostic des grossesses molaires est excellent. En cas d’évolution vers une TTG, la survie est proche de 100 % avec un traitement adapté. Modes de diagnostic Seul l’examen histologique des produits de curetage permet d’affirmer le diagnostic. Aujourd’hui, l’échographie et le dosage sérique des hCG permettent souvent la suspicion diagnostique avant l’intervention (figure 1). Figure 1. Aspect échographique de môle complète à 6 SA. hCG = 940 000 Ui/l. La performance diagnostique de l’échographie est bonne pour les MC, autour de 90 %. Elle est médiocre pour les MP, autour de 30 %. Les hCG sériques sont élevés dans près de 90 % des MC, mais dans moins de 10 % des MP. L’avis d’un anatomopathologiste spécialisé est capital dans les cas douteux. Presque 20 % des MP qui ont bénéficié d’une relecture par un pathologiste référent de notre centre ont été requalifiées en MC. Traitement des grossesses môlaires En cas de suspicion de grossesse môlaire, l’évacuation utérine est la règle. Il n’y a pas lieu de réaliser de bilan d’extension avant le geste. Nous réalisons une aspiration curetage sous anesthésie générale avec échoguidage. Une perfusion d’ocytociques est débutée dès la fin du geste. Les prostaglandines n’ont pas leur place dans l’évacuation d’une grossesse môlaire. Un contrôle échographique est nécessaire 10 jours plus tard. Le taux de rétention (image intracavitaire de diamètre antéropostérieur > 17 mm) est proche de 20 %. Si un 2e curetage peut se justifier devant une rétention avérée, un 3e curetage n’a pas sa place. S’il reste du matériel intra-utérin et que la décroissance des hCG n’est pas satisfaisante, alors vient le temps du traitement médical. Une hystérectomie peut se discuter au cas par cas, chez une patiente de plus de 40 ans, sans désir de grossesses. Il n’est pas licite de réaliser plus de 2 aspirations/curetages pour le traitement d’une grossesse môlaire. Aucun bilan d’extension n’est nécessaire avant une aspiration curetage pour une grossesse môlaire. Pourquoi surveiller après évacuation ? Le risque de TTG est de 15 % après une MC, et inférieur à 5 % après une MP. C’est habituellement la mauvaise décroissance des hCG dans les semaines suivant l’évacuation qui permettra de porter ce diagnostic de TTG. La surveillance des hCG sériques est hebdomadaire jusqu’à négativation, puis mensuelle. Après négativation, la surveillance doit se poursuivre pendant 6 mois pour une MP et 12 mois pour une MC. La réalisation d’une courbe semi-logarithmique simplifie la surveillance de la décroissance. Une contraception adaptée doit être instaurée pendant cette période. Il n’y a pas de contre-indications aux estroprogestatifs. La surveillance des hCG doit être rigoureuse. Un retard diagnostique est associé à un moins bon pronostic. Critères diagnostiques d’une TTG Ils ont été édictés par la FIGO en 2000 : • Évolution anormale des hCG après évacuation d’une môle : – augmentation des hCG sur 3 dosages hebdomadaires consécutifs sur au moins 2 semaines (J1, J7, J14) (figure 2) ; – hCG en plateau sur 4 dosages hebdomadaires consécutifs sur au moins 3 semaines (J1, J7, J14, J21) (figure 3) ; – hCG qui restent positifs plus de 6 mois après l’évacuation utérine. • Choriocarcinome. Il est important de noter qu’un diagnostic histologique n’est pas indispensable et que les TTG sont les seules tumeurs malignes de l’espèce humaine pouvant être traitées par chimiothérapie sans preuve histologique. L’évolution anormale des hCG est suffisante au diagnostic de TTG. De la même façon, il est important de noter que le diagnostic par histologie de môle invasive ne justifie pas le diagnostic de TTG si les hCG décroissent de façon satisfaisante. Un bilan d’extension n’est réalisé qu’une fois le diagnostic de TTG posé. Il comporte : • IRM pelvienne + échographie vaginale avec Doppler ; • scanner thoraco-abdominal et radio de thorax si localisation pulmonaire ; • IRM cérébrale. Les résultats de ce bilan permettent de calculer le score FIGO qui guide les modalités thérapeutiques (tableau 2). Un stade anatomique est également proposé. Il ne modifie pas la conduite à tenir. Stade I : maladie limitée à l’utérus. Stade II : maladie étendue hors de l’utérus, mais limitée aux structures génitales. Stade III : maladie étendue aux poumons, avec ou sans atteinte connue du tractus génital. Stade IV : tout autre site métastatique. Les critères diagnostiques d’une tumeur trophoblastique gestationnelle sont basés sur l’évolution des hCG et sur des critères histologiques de choriocarcinome. Un bilan d’extension ne se justifie qu’une fois le diagnostic posé. Modalités thérapeutiques Score ≤ 6 : mono-chimiothérapie type méthotrexate. Score ≥ 7 : polychimiothérapie type EMA-CO. N.B. Les protocoles méthotrexate préconisés sont très différents de ceux utilisés pour le traitement d’une GEU. EMA/CO : etoposide, méthotrexate, actinomycine, cyclophosphamide, Oncovin® (vincristine). Cas particuliers Les tumeurs trophoblastiques du site placentaire et les tumeurs trophoblastiques épithélioïdes sont très rares, et surviennent le plus souvent après une grossesse normale. Le taux d’hCG est souvent bas. Du fait d’une faible chimiosensibilité, le traitement repose essentiellement sur l’hystérectomie. Les nodules du site placentaire et les exagérations du site placentaire sont des lésions bénignes et non môlaires. Le fonctionnement du Centre de Référence des Maladies Trophoblastiques de Lyon Créé en 1999, et labellisé INCa, le centre enregistre les cas déclarés de grossesses molaires ou de TTG à l’initiative des médecins qui les prennent en charge. Il apporte des conseils diagnostiques ou de prise en charge si les praticiens le souhaitent. Des protocoles thérapeutiques sont à la disposition des médecins. Un formulaire est adressé au médecin qui déclare le cas, ainsi qu’un consentement à la patiente. Une relecture des lames histologiques est organisée pour confirmer le diagnostic. Le suivi des hCG est assuré conjointement par le centre, qui adresse régulièrement une courbe semi-logarithmique de décroissance aux médecins de la patiente. À l’initiative du centre, des Recommandations pour la Pratique Clinique sont sur le point d’être publiées. Contact Centre de Référence des Maladies Trophoblastiques de Lyon : Attachée de Recherche Clinique : Touria HAJRI Tél. : 04 72 41 32 41 touria.hajri@chu-lyon.fr www.mole-chorio.com
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :

