Publié le 15 juin 2014Lecture 16 min
Dépistage organisé du cancer du sein : réponses aux polémiques
S. TAIEB (1), L. CEUGNART (1), M. DEGHAYE (2), S. HABER (3), P. VENNIN (1) - 1. Département d’imagerie. Centre régional de Lute Contre le Cancer Oscar-Lambret, Lille 2. Centre Imagerie Médicale, Dammarin-en-Goële 3. Clinique Vauban, Livry-Gargan
La diminution de mortalité spécifique par cancer du sein, démontrée dans les grandes métaanalyses des années 1980, a été à l’origine de la mise en place de programmes de dépistage du cancer du sein dans de nombreux pays, dont la France, véritables programmes de santé publique. Des publications récentes ont remis en cause l’intérêt du dépistage en insistant sur les effets négatifs, en particulier le sur-diagnostic et l’absence d’impact significatif sur la mortalité. À partir d’une analyse de la littérature, et notamment des travaux de synthèse indépendants publiés en 2012, nous apportons des éléments de réponse aux médecins face aux interrogations légitimes des femmes. Ces travaux confirment que le dépistage dans la classe d’âge permet une diminution de la mortalité spécifique d’au moins 20 % au prix d’un surdiagnosic estimé entre 1 et 15 %.
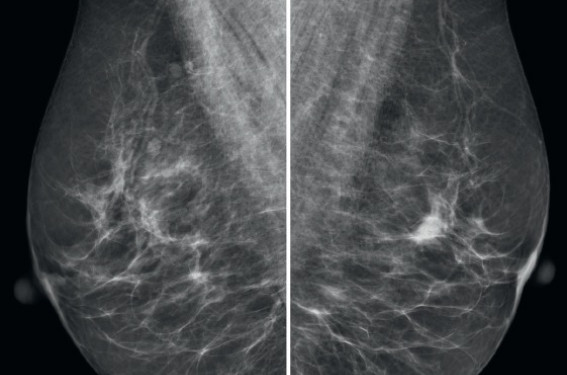
Cf figure. Asymétrie de densité rétro-aréolaire gauche visible en oblique. Le dépistage du cancer du sein organisé par mammographie fêtera, l’année prochaine, ses 10 ans de déploiement à l’ensemble du territoire français. L’organisation conçue dans les années 1990, originale dans le monde, entre autres grâce à son caractère décentralisé, a montré son efficacité, notamment sur les critères européens d’évaluation précoce de qualité du programme(1). Seul le taux de participation ne répond pas à ce qui est attendu, puisqu’il n’est actuellement en moyenne que de 52 % au lieu de 70 % (minimum recommandé). L’objectif de 65 % de participation souhaité dans le cadre du second plan cancer ne sera pas atteint fin 2013. Les polémiques récurrentes sur l’inefficacité et les effets délétères de ce dépistage ne peuvent expliquer à eux seuls l’insuffisance de participation, mais contribuent sans doute à ralentir la progression du taux de participation, ralentissement constaté depuis 2004. En effet, en dépit des résultats très positifs des essais randomisés des années 1980 sur la mortalité spécifique par cancer du sein, des travaux et publications ciblés sur les effets négatifs du dépistage (absence d’impact sur la mortalité, surdiagnostic, faux positifs) ont été repris dans les médias généralistes, et encore tout récemment dans le mensuel Que choisir(2). Les professionnels de santé n’avaient pas attendu ces articles pour s’interroger sur les effets indésirables potentiels de cette action de santé publique et sur ses conséquences, comme en témoigne le thème du congrès de la Société française de pathologie mammaire à Marseille en 2011, qui portait sur le surdiagnostic et le surtraitement. En 2012, en réponse aux détracteurs du dépistage mammographique, les résultats de 2 groupes de travail indépendants ont été publiés(3-4). Ces données doivent être connues afin de répondre clairement non seulement aux femmes qui s’interrogent, à juste titre, sur les avantages et inconvénients de cette action de santé publique, mais aussi à l’ensemble des acteurs de soins. La polémique sur le dépistage s’organise autour de 3 grands axes : l’impact sur la mortalité spécifique, le surdiagnostic et les faux positifs. Dépistage organisé et mortalité Les métaanalyses de la Cochrane Collaboration, publiées la première fois en 2001 et actualisées à plusieurs reprises depuis(5-7), font état d’une diminution de la mortalité de l’ordre de 10 %, soit 1 vie sauvée pour 2 000 femmes au prix de 200 faux positifs et de 10 cas de surdiagnostic. Ces estimations sont donc très différentes des résultats des grands essais contrôlés randomisés et de la métaanalyse publiée en 1995(8) qui avaient fait espérer une diminution de la mortalité par cancer du sein de l’ordre de 30 %. Jorgensen et coll.(9), dans un travail récent fondé sur une analyse de la mortalité par cancer du sein et de son incidence d’une base de données au Danemark, concluaient même que la baisse de la mortalité était supérieure dans le groupe des femmes « non dépistées », versus « dépistées » respectivement de 2 et 1 %. Une étude norvégienne a montré que la baisse du nombre de décès constatée entre 2 comtés, l’un avec et l’autre sans programme de dépistage, était estimée aux alentours de 18 %, dont 10 % étaient à mettre au compte de l’amélioration des traitements et des prises en charge(10). On sait déjà depuis longtemps qu’il est illusoire de rechercher une baisse de la mortalité globale, puisque les décès par cancer du sein ne représentent, au pire, que 15 % de la mortalité féminine selon des données nationales publiées par l’INCa(11). Concernant la mortalité spécifique, les données citées par les partisans de la Cochrane Collaboration doivent être examinées avec précaution puisqu’elles ne sont pas dérivées des résultats des essais randomisés mais de « l’estimation raisonnable » que les auteurs en ont faite, comme l’a signalé l’excellente mise au point réalisée par S. Duffy dans le BEH de septembre 2012(12). Par ailleurs, comme l’avait signalé Hendrick(13), le nombre de décès évités est toujours rapporté au nombre de femmes invitées dans le programme et non au nombre de femmes réellement dépistées. Au vu des taux de participation qui fluctuent entre 50 et 80 %, les chiffres sont totalement différents, passant de 1 décès évité pour 2 000 femmes suivies tous les ans pendant 10 ans selon les estimations de la Cochrane Collaboration à 1 vie sauvée pour 455, 303 et 426 femmes réalisant effectivement leur mammographie tous les 2 ans entre 50 et 59, 60 et 69 et 70 et 79 ans respectivement(13). Enfin, les décès par cancer du sein apparaissent, dans la grande majorité des cas, de nombreuses années après la découverte de la maladie. Or, la plupart des travaux mettant en doute l’effet du dépistage manquent du recul nécessaire (6 années seulement de suivi dans la publication de Zahl et coll.(14)). L’analyse de la mortalité dans l’étude suédoise des 2 comtés(15) montre en effet que l’impact positif se majore à long terme, passant de 26 % à 10 ans à 31 % avec un suivi de 29 ans. Ainsi, 16 cancers ont été évités dans le groupe dépisté, correspondant à une réduction de mortalité équivalant à 1 vie épargnée pour 300 femmes suivies 10 ans. Le surdiagnostic Définition La définition du surdiagnostic varie en fonction des auteurs. Pour certains, il correspond à la découverte par le dépistage d’un cancer qui ne sera pas responsable du décès de la personne, pour d’autres, à un cancer qui n’aurait pas été diagnostiqué durant la vie en l’absence de dépistage. Cette dernière définition moins restrictive permet de prendre en compte l’ensemble des effets négatifs (personnels, familiaux ou sociétaux) de la découverte et du traitement d’un cancer. Le surdiagnostic constitue une problématique qui doit être prise en compte, essentiellement du fait des traitements qui en découlent. En effet, en l’absence d’éléments objectifs (imagerie, histologie, biologie, etc.) permet- tant lors du diagnostic initial de distinguer un cancer à potentiel évolutif de celui qui resterait stable, dans l’état actuel des référentiels français et internationaux et en dehors de situations cliniques exceptionnelles, un traitement sera systématiquement proposé pour tout cancer du sein découvert. Le surdiagnostic n’est pas spécifique au cancer du sein, mais est rapporté également pour le poumon, la thyroïde, le rein et surtout la prostate(16). La réflexion conduite sur le surdiagnostic est décrite dans d’autres domaines, concernant en fait tout acte d’investigation radiologique, biologique ou fonctionnel dont les conséquences devraient être appréhendées par tous les prescripteurs. Estimation L’estimation du taux de surdiagnostic est très variable dans la littérature (entre 1 et 50 %). Ce taux dépend bien évidemment du type de cancers pris en compte (lésion invasive uniquement ou in situ associée), mais également de la méthode de calcul (analyse comparative des données d’incidence et de mortalité dans des régions ou pays avec et sans campagne de dépistage, dans des temporalités identiques ou différentes, durée du lead time bias, etc.). Pour les détracteurs du dépistage, ce taux est supérieur à 25 %, certains considérant même que tous les carcinomes in situ correspondent à du surdiagnostic. Les 3 principaux éléments mis en avant en faveur du surdiagnostic sont : • L’augmentation très importante de l’incidence du cancer du sein au cours des 20 dernières années sans baisse de la mortalité, qui ne peut pas être expliquée seulement par l’amélioration thérapeutique. Ainsi, à partir d’une analyse de l’incidence de cancer du sein en France sur des cohortes de femmes nées à 3 périodes différentes, B. Junod et coll.(17) retrouvent une augmentation de 76 et 23 % de l’incidence (entre 50-65 ans et 65-79 ans respective- ment) sans modification de la mortalité. Ce type d’analyse n’est cependant pas fiable car, comme signalé dans le travail de l’EUROSCREEN(3), la comparaison de cohortes à des périodes, dans des régions ou des conditions socio-économiques différentes engendre des biais majeurs, notamment liés à des facteurs de risque différents et à l’effet cohorte. Ainsi, le risque cumulé de 0 à 74 ans de décès par cancer du sein d’une femme née en France en 1910 était d’environ 5 %, il est de plus de 12 % pour une patiente née en 1980(18). Dans d’autres situations, la comparaison de l’incidence avant et après la mise en place de l’action de dépistage dans la même population, induit un biais lié au vieillissement de la classe d’âge. Enfin, dans toutes les études de cohortes se pose le problème de la contamination du groupe témoin par des patientes qui effectuent aussi des mammographies et qui bénéficient donc de celles-ci sans être comptabilisées dans le groupe « dépistées ». • L’absence de diminution de l’incidence de cancer à la fin de la période de dépistage Logiquement, si le dépistage permet de découvrir plus tôt des lésions infracliniques, on devrait constater une diminution de l’incidence pendant les premières années suivant l’arrêt du dépistage. Jørgensen et coll.(19) déclarent que cela n’a jamais été constaté. Or, dans un article publié en 2012, Kalager et coll., qui ne peuvent être considérés comme pro-dépistage, montrent une diminution de 14 % de l’incidence dans les quatre ans suivant la fin du dépistage dans une population norvégienne(20). • L’absence de diminution des stades évolués de cancer du sein Ce troisième argument a été rapporté principalement par Autier et coll.(21) qui, à partir d’une étude des données publiées des registres de 4 pays (Irlande du Nord, Écosse, États-Unis, Tasmanie) ont montré une stabilité du taux de cancers de stade avancé malgré plus de 7 ans de dépistage et plus de 60 % de participation. Les auteurs en concluent que la mammographie dépiste principalement des lésions infracliniques non évolutives et ne permet pas de trouver les cancers les plus agressifs. Ces résultats sont complètement opposés à ceux publiés par les Anglais(22) à partir de l’analyse de la survie à 10 ans (et non comme l’étude citée ci-dessus, à partir d’une analyse de publications) de 2 cohortes de 7 700 patientes traitées pour un cancer infraclinique comparativement à plus de 11 000 femmes ayant eu un cancer « symptomatique ». Le taux de cancers de plus de 30 mm était de 6,4 % dans le groupe « dépistées » versus 21 % pour les témoins. Si on retient le taux d’envahissement ganglionnaire (quelle que soit la taille lésionnelle), celui-ci était de 28 % et 50 % respectivement. La survie était évidemment corrélée de façon positive au mode de découverte, puisque les femmes dépistées avaient une survie à 10 ans estimée à 77 % (en tenant compte de l’effet lead time, c’est-à-dire de l’avance au diagnostic induite par le dépistage) soit un gain de 12, 5 % par rapport aux femmes « symptomatiques ». Les données indépendantes Au vu de la polémique sur les effets négatifs des programmes de dépistage organisés induite par les nombreux articles publiés au cours des dernières années et de la virulence des commentaires publiés dans ces revues(23), des études indépendantes ont été effectuées et publiées en 2012. Synthèse du groupe de travail EUROSCREEN(3) Ce groupe de travail européen regroupe de nombreux épidémiologistes qui, pour certains, participent à leurs programmes de dépistage national. La synthèse de leurs analyses communes des données publiées montre que la diminution de la mortalité induite par les programmes organisés est estimée, pour les études fondées sur l’étude de l’incidence, entre 25 % et 38 % en fonction respectivement du statut d’invitées ou de participantes. Pour les études cas- contrôles, la réduction était encore plus importante, estimée à 31 % et 48 % après ajustement sur le biais d’auto- sélection (self sélection bias). En ce qui concerne le surdiagnostic, celui-ci était estimé entre 1 et 10 % en fonction des méthodes d’analyse. Enfin, le risque de faux positif (rappel inutile, biopsie a posteriori bénigne) était estimé à 20 % (17 % de rappels et 3 % d’actes interventionnels) pour 10 ans de suivi à raison d’une mammographie biennale. Résultat de l’analyse indépendante au Royaume-Uni(4) Le pragmatisme anglo-saxon a de nouveau été démontré puisque, à la suite des attaques virulentes émises contre le dépistage et les remarques sur les conflits d’intérêts de tous les auteurs pro-dépistage, les autorités de tutelle ont nommé une commission indépendante sous la responsabilité de Sir M. Marmott, chargée d’analyser les résultats. Cet épidémiologiste de renom n’a jamais travaillé dans le domaine du dépistage du cancer du sein. Les conclusions indépendantes de l’analyse des résultats des 11 études randomisées confirment la réduction de 20 % de mortalité induite par ce type de programme. Considérant que ces travaux princeps ont plus de 30 ans, ils ont aussi analysé les résultats des études observationnelles anglaises récentes qui montrent un bénéfice encore supérieur, mais le groupe émet pour ces études récentes des réserves sur de potentiels biais. Le taux de surdiagnostic, principalement à partir de 3 études randomisées, est estimé entre 11 et 19 %. En valeur absolue, pour 10 000 femmes invitées à partir de 50 ans et pour les 20 ans suivants, à raison d’une mammographie tous les 3 ans (programme anglais), 43 décès seront évités : cela équivaut à 1 vie gagnée pour 235 femmes invitées et 180 femmes participantes, bien loin des estimations de la Cochrane Collaboration (1 décès pour 2 000 femmes invitées). En contrepartie, dans la même population et sur la même durée, 129 cancers (invasifs et in situ) correspondraient à du surdiagnostic. Cela peut paraître important, mais en fait, pour les 307 000 femmes anglaises de la classe d’âge 50- 52 ans, le risque cumulé sur les 20 années suivantes n’est que de 1 %. Les autres éléments non abordés dans ces analyses et études contradictoires concernent le principe même du dépistage organisé. Inconvénients du dépistage organisé Nous n’avons abordé dans cette synthèse que les arguments de réduction de mortalité et de surdiagnostic, mais il convient de ne pas oublier le risque de faux positifs en première et seconde lecture, dont la fréquence est estimée dans la littérature entre 3 et 17 % (induisant des reconvocations après L2 et parfois des gestes interventionnels)(3). Ces chiffres ne sont cependant pas transposables dans l’organisation du dépistage en France, puisque le radiologue peut réaliser le bilan de diagnostic immédiat (BDI) lors de la découverte d’une anomalie sur un bilan de dépistage. Ainsi, en 2009, de 7,4 % de dépistage positif avant bilan (qui correspond au taux recommandé du « taux de rappel » européen), on passe à 1,3 % de bilan de diagnostic suspect après BDI(22), ce taux étant similaire à celui estimé par les experts d’EUROSCREEN(3). Enfin, on ne peut méconnaître la problématique de l’irradiation pour laquelle un certain nombre de travaux scientifiques sont en cours. Avantages du programme de dépistage organisé De la même manière, nous n’avons pas traité les avantages de la mise en place de ces campagnes de dépistage que sont le contrôle qualité des maté- riels et des pratiques ainsi que l’évaluation des résultats. En termes de contrôle qualité, l’obligation pour tout radiologue et manipulateur d’effectuer une formation spécifique au dépistage, mais également de procéder à une validation quotidienne, hebdomadaire et semestrielle de la qualité des mammographes, permet d’assurer à toutes les femmes une qualité de prise en charge de très haut niveau sur l’ensemble du territoire français, avec une deuxième lecture qui permet de « récupérer » 5 à 12 % de cancers non détectés par le premier lecteur. Enfin, l’évaluation annuelle des campagnes de dépistage donne aux instances, mais aussi aux radiologues, des résultats actualisés en termes de techniques mammographiques (analogique versus numérique, dose délivrée), de détection, de diagnostic et de suivi des femmes dépistées. L’ensemble des critiques émises par les détracteurs de ce type de programme serait impossible à formuler en l’absence de ce processus d’évaluation (comme en témoigne l’absence d’analyse possible des performances du dépistage individuel). Conclusion La mise en place de programme de santé publique de dépistage présente des avantages et des inconvénients. Au vu des travaux indépendants publiés récemment sur le dépistage organisé du cancer du sein entre 50 et 75 ans, il apparaît que ces derniers (surdiagnostic, faux positifs, irradiation) ne remettent pas en cause l’intérêt de ce programme qui engendre une diminution d’au minimum 20 % de la mortalité spécifique. Il est important que l’ensemble des professionnels de santé connaissent ces données et expliquent à leurs patientes les éléments positifs de ce type d’action, sans en occulter les effets négatifs et sous la forme d’une information claire et loyale. Le refus de cette action de santé publique en raison des effets indésirables potentiels n’est pas une conduite qui doit être conseillée aux femmes par les médecins, en raison de la balance bénéfices/risques en faveur du dépistage. Si la femme refuse le dépistage en connaissance de cause, il s’agit alors d’une décision individuelle qui doit bien évidemment être respectée. Mais dans ce cas, il est inapproprié de proposer un dépistage mammographique individuel qui n’évitera aucun des inconvénients précédents (qui ne sont pas ceux du programme de dépistage mais ceux de la mammographie) et exposera la patiente à un risque accru de faux négatif en raison de l’absence de seconde lecture. L’espoir se porte sur les techniques d’analyse génomique et de biologie moléculaire, qui apporteront probablement, dans l’avenir, des réponses au problème non résolu par les moyens actuels (imagerie, histologie ou clinique) des cancers non ou peu évolutifs définis comme du surdiagnostic.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :