Cancérologie
Publié le 08 mar 2022Lecture 10 min
Cancers séreux de bas grade : implications chirurgicales
L.-S. TALAGRAND*, F.-E. LAAS*, H. BONSANG KITZIS**, V. FOURCHOTTE*, J.-G. FERON*, F. REYAL*,***, F. LECURU*,***, Paris
Le traitement des cancers de l’ovaire a beaucoup évolué depuis 15 ans. L’acceptation du concept de résection chirurgicale complète, la possibilité d’une chirurgie d’intervalle, l’apport du bevacizumab, l’apport des inhibiteurs de PARP pour certaines patientes et le traitement plus efficace des récidives ont amélioré le pronostic. Cependant, ces progrès ont principalement été obtenus pour les cancers séreux de haut grade et leur apparenté, très souvent chimiosensibles, et présentant fréquemment une mutation d’un gène BRCA ou un déficit de recombinaison homologue. En revanche, le traitement des autres types de cancers de l'ovaire a peu évolué.
Le cancer séreux de bas grade est un sous-type méconnu du cancer de l'ovaire. Il a été séparé des cancers séreux de haut grade il y a quinze ans par Malpica et coll. grâce à l’introduction d’une classification en deux niveaux (haut grade vs bas grade) des cancers séreux, précédemment distingués selon le grade en trois niveaux (grade 1 vs 2 vs 3)(1).
Il s’agit d’une maladie rare, puisque représentant environ 2 % des cancers épithéliaux et 5 % des cancers séreux de l’ovaire. À ce titre, chaque cas devrait être présenté à l’une des RCP du réseau national des tumeurs rares gynécologiques, labellisé par l’INCa (www.ovaire-rare.org)(2).
Il se distingue, sur le plan biologique, moléculaire et génétique, de tous les autres types de cancers ovariens (tableau 1). En particulier, les mutations de p53 sont rares, ainsi que les mutations d’un gène BRCA. Il exprime plus fréquemment les récepteurs hormonaux, notamment aux estrogènes.
Il atteint une population plus jeune avec un âge médian au diagnostic de 45 ans. Il peut apparaître « de novo », principalement sous la forme d’une carcinose péritonéale, ou être l’évolution d’une tumeur frontière séreuse. Le pronostic est réputé meilleur, avec un caractère indolent(3).
Jusqu’à présent, les recommandations de prise en charge ont été calquées sur celle des cancers séreux de haut grade. Cependant, sa faible chimiosensibilité (ou plus inconstante) fait que les indications habituelles ne peuvent pas s’appliquer systématiquement pour le cancer de bas grade. Deux cas de figure schématiques doivent être envisagés.
1er cas : une masse annexielle compatible avec une tumeur séreuse frontière ou maligne
Cette situation est la plus rare. Nous sommes face à une masse annexielle uni ou bilatérale, complexe, compatible en imagerie avec une tumeur séreuse frontière ou maligne. Il n'y a pas de carcinose visible associée. Le CA125 est augmenté. La prise en charge commence par une cœlioscopie diagnostique dont l’objectif est de rechercher et le cas échéant de cartographier les implants extra-ovariens, ainsi que de caractériser la ou les masses annexielles (le compte rendu doit être complet et précis, avec calcul du score PCI en cas d’implants). On réalise une annexectomie cœlioscopique ou par laparotomie en fonction de la taille de la masse ou en présence d’adhérences (préférer une laparotomie si le diamètre est supérieur à 6 cm). L’objectif est de faire l’exérèse complète sans rupture de l’annexe. En cas de cœlioscopie, il est nécessaire de respecter les règles de la chirurgie oncologique (ensachage, etc.). Il est impératif de faire la résection de tous les éventuels implants associés. En l’absence d’implant, on doit systématiquement réaliser une omentectomie infra-colique ainsi que des biopsies péritonéales dans le pelvis, les gouttières, le mésentère et les coupoles. Les curages pelviens et aortico-caves sont recommandés. En cas de ganglions métastatiques, le stade devient IIIa avec une indication de traitement médicamenteux complémentaire. L’examen extemporané ne permet généralement pas de différencier une tumeur séreuse de bas grade, d’une tumeur frontière séreuse. On est souvent amené à faire l’intervention en deux temps.
La question de la préservation de la fertilité se pose régulièrement dans ce cas de figure. Le cancer séreux de bas grade n’est pas une contre-indication. Les critères de sélection sont le stade (Ia à Ic1) et une stadification complète et négative. Les autres critères (âge, bilan d’oncofertilité, etc.) sont les mêmes que pour les autres préservations de fertilité. À noter que la simulation ovarienne est contre-indiquée chez ces patientes.
Le suivi devra comporter des examens cliniques réguliers, ainsi que des dosages de CA125 (notamment s’il était élevé lors de la prise en charge initiale) ainsi que des imageries thoraco-abdomino-pelviennes. Les récidives peuvent en effet survenir sous forme de carcinose. En cas de traitement conservateur, des échographies pelviennes sont associées.
2e cas : diagnostic d’une carcinose péritonéale
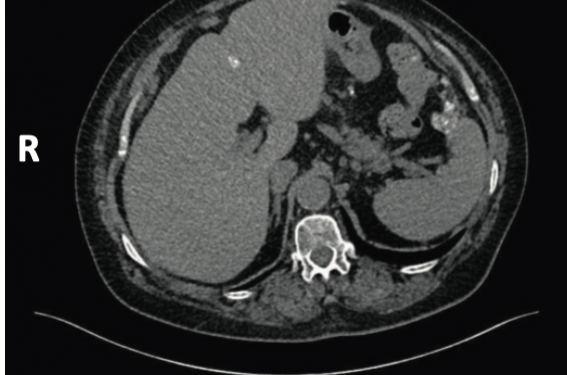
Quelques particularités peuvent faire évoquer le diagnostic de cancer séreux de bas grade. L’âge est souvent plus jeune que pour les cancers de haut grade. L’évolution a été lente depuis l’apparition des premiers symptômes, souvent plus de six mois. Le scanner montre des calcifications (psamomes) (figures 1 à 4). Le CA 125 est peu élevé en comparaison de l’étendue de la carcinose. Idéalement la patiente doit être adressée à une équipe spécialisée pour la prise en charge des cancers de l’ovaire(4). Une biopsie permet de porter le diagnostic. Elle peut être réalisée par cœlioscopie ou par un guidage radiologique selon les cas. Rappelons qu’il s’agit d’une tumeur rare. Le diagnostic doit être confirmé par un pathologiste référent en oncogynécologie. Les RCP du réseau des tumeurs malignes rares gynécologiques offrent la possibilité de relecture par un panel d’experts(2).
La cartographie de la carcinose est l’élément clé. Elle repose sur la radiologie, mais surtout la cœlioscopie. La topographie des implants est différente de celle observée dans les cancers séreux de haut grade(5). Elle prédomine au niveau pelvien, imposant le plus souvent une exérèse en bloc du recto-sigmoïde, du cul-de-sac de Douglas, de l’utérus, des annexes et du péritoine pelvien (intervention de Hudson). Dans l’abdomen, il y a moins d’implants qu’avec les cancers de haut grade, mais ils sont plus volumineux, infiltrant les issus sous-jacents et situés dans des zones anatomiques posant des limites à la résection : angle duodéno-jéjunal, face postérieure de l’estomac, implants étagés sur la plus grande parie de l’iléon (souvent à la limite entre le méso et l’iléon), etc. La cœlioscopie doit méthodiquement explorer tous ces territoires. Les points bloquants sont différents de ceux reconnus pour les cancers de haut grade. Le PCI doit être calculé, mais les seuils utilisés pour aider à la décision dans les cancers de haut grade ne sont pas valables ici. Enfin la cœlioscopie sous-estime fréquemment l’extension exacte de la carcinose. La cytoréduction devra commencer par une exploration rigoureuse et la vérification de la résécabilité.
Prise en charge
Si une résection complète de la carcinose peut être obtenue et si l’état général de la patiente permet une intervention lourde, une intervention peut être programmée. Idéalement elle ne devrait être réalisée que par une équipe habituée aux chirurgies complexes de carcinose(4). Elle est associée à une préparation avec correction de la dénutrition ; une réanimation per et postopératoire ainsi qu’un programme de réhabilitation améliorée et un circuit comprenant obligatoirement un passage en USC, USI ou réanimation chirurgicale. L’intervention commence par un inventaire de la carcinose et une exploration complète, notamment des zones empêchant une résection complète (angle de Treitz, résection iléale étendue responsable d’un grêle court), ou d’une association de lésions incompatibles avec une qualité de vie décente (gastrectomie totale, colectomie totale). Il faut à l’avance prévoir les conséquences fonctionnelles des gestes envisagés (dévascularisation gastrique due à une omentectomie radicale associée à une résection complète du petit épiploon). Il faut également additionner les résections nécessaires et s’assurer qu’elles sont compatibles avec des suites opératoires acceptables (diaphragme droit + grêle + colon gauche + curages, etc.). C’est autant la décision qui est compliquée et nécessite de l’expertise et des collaborations, que le geste lui-même.
La résection complète est l’objectif. Toutes les séries de chirurgie première montrent que les patientes sans reliquat tumoral visible en fin d’intervention ont la meilleure survie. L’analyse a posteriori de l’essai GOG 182 montre une PFS de 33 mois et une OS de 97 mois après résection première complète vs 14 et 35 mois en cas de reliquat > 1 cm(6). Dans l’étude de J.P. Grabowski et coll. qui regroupe les données de quatre essais thérapeutiques sur des cancers avancés de l’ovaire, les meilleures survies sont observées après résection complète. La survie diminue avec l'importance du résidu. En cas de résidu > 1 cm, la chirurgie est même inutile(7). L’analyse de la base TMRG confirme cette donnée avec une PFS équivalente chez les patientes avec une résection CC2 ou plus que chez les patientes non opérées. En revanche, il apparaît qu’un reliquat minime est acceptable dans cette pathologie(8). L’étude de J.P. Grabowski et coll. montre que la chirurgie améliore le pronostic pour les reliquats compris entre 0 et 10 mm(7). Dans l’analyse de la base TMRG, nous avons observé que la survie était identique après chirurgie première pour les résections CC0 et CC1 (reliquat < 2,5 mm)(8). Cela ne veut pas dire qu’on peut se limiter à la résection des implants faciles à enlever, mais qu’un reliquat minime, à l’issue d’une intervention ayant fait un effort chirurgical maximal (objectif résection complète), est une situation acceptable.
Les curages pelviens et aorticocaves sont classiquement recommandés. Cependant depuis la publication de l’essai LION, même si celui-ci n’a inclus qu’une minorité de cancers de bas grade, leur réalisation systématique est discutée(9). De plus, une autre étude n’a pas retrouvé d’amélioration de la survie, après curages, pour les cancers séreux de bas grade(10). Ils ne sont donc réalisés qu’en présence d’adénopathies radiologiques ou constatées lors de l’exploration chirurgicale. Enfin, la morbidité de ces interventions est importante, au moins équivalente à celle observée après chirurgie première des cancers séreux de haut grade(7). Le traitement adjuvant comporte une chimiothérapie à base de plaine (6 cycles) ± bevacizumab selon les stades. Une hormonothérapie peut être proposée en entretien.
Cependant toutes les patientes ne peuvent bénéficier d’une intervention première. Dans l’étude de J.P. Grabowski et coll., 25 à 50 % des patientes ont un reliquat substantiel qui aurait fait poser une indication de chimiothérapie néoadjuvante en France(7). L’analyse de la base TMRG montre qu’environ la moitié des patientes ayant une carcinose due à un cancer séreux de bas grade ne sont pas résécables d’emblée (stade IVB ou carcinose non résécable(8). L’utilité d’une chimiothérapie néoadjuvante se pose alors. Malheureusement les cancers séreux de bas grade sont peu chimiosensibles. Le taux de réponse est faible avec plus de 80 % de maladies stables. Cependant, environ 10 % présentent une réelle réponse selon les critères RECIST (> 30 % de réduction de la taille tumorale) et même 20 % lorsqu’on prend en compte les réponses mineures (10 à 30 % de réduction de la taille tumorale)(7). Le Ki67 a été proposé pour sélectionner les répondeuses potentielles, mais ces résultats préliminaires n’ont pas été confirmés(11). Cependant, contrairement à ce qui est observé dans les cancers de haut grade, la chimiothérapie néoadjuvante n’améliore pas le PCI, ne réduit pas la complexité chirurgicale (scores d’Alei et score de Pomel), ne réduit pas la fréquence des résections digestives et n’augmente pas le taux de résection complète(8). Il y a même plus de complications postopératoires(8). La survie reste inférieure à celle des patientes opérables initialement(8). Dans les cancers séreux de bas grade, la chimiothérapie néoadjuvante est le plus souvent une solution palliative qui ne simplifiera pas la prise en charge de la patiente et n’améliorera pas son pronostic.
Lors des récidives la chirurgie peut être une option. Nous avons très peu de données spécifiques. Seule une minorité de patientes avec des cancers séreux de bas grade ont été incluses dans les essais sur la chirurgie de la récidive. Il en ressort que les patientes ayant un intervalle libre long et pouvant bénéficier d’une chirurgie complète semblent avoir un meilleur pronostic. Ici encore, la discussion dans une RCP du réseau TRMG(2) et la prise en charge par une équipe spécialisée(4) sont nécessaires, autant pour poser l’indication que pour réaliser le geste. Il faudra bien sûr tenir compte de la maladie présente et de sa distribution, mais également des gestes effectués lors de l’intervention initiale (résections digestives notamment). La chimiothérapie est peu efficace dans ces situations. Les thérapies ciblées par les inhibiteurs de Mek sont une voie d’avenir.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :