Publié le 01 sep 2015Lecture 13 min
Herpès génital : situation actuelle et perspectives
J.-M. BOHBOT, Institut Fournier, Paris
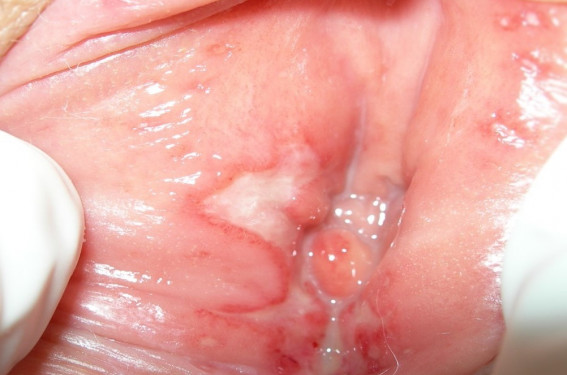
Si la piste d’un vaccin prophylactique vis-à-vis de l’herpès génital semble dans l’immédiat assez compromise, la vaccination thérapeutique progresse rapidement à la lumière des derniers résultats des essais phase II. Cet article fait le point sur les stratégies diagnostiques, les nouveautés en matière de traitement symptomatique et l’état des études vaccinales.
L’herpès génital fait partie des infections sexuellement transmissibles (IST) les plus fréquentes. Sa prévalence semble stable depuis quelques années, mais la proportion de sujets infectés et non diagnostiqués demeure importante, avec un risque non négligeable de transmission virale. L’herpès génital n’est pas une maladie grave, mais elle demeure très anxiogène pour les sujets atteints et leur entourage. Même si cette infection n’est qu’exceptionnellement génératrice de complications, elle retentit de manière très délétère sur la qualité de vie du fait de son imprévisibilité, de son incurabilité et des symptômes locaux souvent fort désagréables. Épidémiologie Dans tous les pays développés, la prévalence de cette infection est stable depuis quelques années, même si le profil viral des sujets infectés change avec une proportion croissante des infections par HSV1 (autrefois cantonné aux localisations faciales de l’herpès). Aux États-Unis, une enquête menée entre 2005 et 2008(1) retrouve une séroprévalence globale HSV2 de 16,2 %, stable par rapport à 2004 (17 %). Cette même étude souligne que 81 % des sujets séro-HSV2 positifs étaient asymptomatiques ou non diagnostiqués comme porteurs d’un herpès génital. En France, la séroprévalence HSV2 dans la population générale est de 17,2 % selon une étude(2) portant sur plus de 12 000 personnes en 2002 (17,9 % chez les femmes et 13,7 % chez les hommes). Cette prévalence est beaucoup plus élevée chez les sujets HIV-positifs, puisqu’une étude publiée en 2005(3) retrouvait entre 51 et 66 % de sujets co-infectés (HIVHSV2). Cette même étude relevait que 69 % des sujets infectés par HSV2 n’avaient pas été diagnostiqués comme tels précédemment. Ces études de séroprévalence ne prennent pas en compte l’incidence croissante des infections génitales à HSV1, surtout au cours des primo-infections (14,6 % dans une étude américaine publiée en 2005), mais également lors des herpès récurrents (4,2 % dans la même étude)(4). Pour certains auteurs, HSV1 serait même prédominant au cours des herpès récemment diagnostiqués, en particulier dans les tranches d’âge jeunes 16-21 ans (jusqu’à 78 % d’isolement d’HSV1)(5). Il est donc probable que la prévalence de l’herpès génital est plus importante que celle constatée dans les études de séroprévalence HSV2. Histoire naturelle de l’herpès génital HSV1 et HSV2 sont des virus dermo-neurotropes, c’est-à-dire ayant une affinité particulière pour 2 tissus : la peau et le tissu nerveux. Lors d’un contact d’un de ces virus avec une peau ou une muqueuse d’un sujet sain, les cellules épithéliales infectées sont détruites provoquant des lésions caractéristiques : vésicules et érosions cutanéo-muqueuses. Secondairement, les cellules nerveuses du territoire atteint sont infectées et le virus va migrer par voie axonale jusqu’à un ganglion sensitif latéro-médullaire où il va installer son gîte de latence, échappant ainsi à toute action immunitaire. Cette primo-infection peut être totalement asymptomatique ou présenter des formes cliniques trompeuses qui ne permettront pas d’établir le diagnostic. Le virus entre ensuite en phase de latence interrompue par des réactivations, sources de récurrences cliniques ou d’excrétions virales asymptomatiques. La transmission survient au cours de ces deux circonstances. Transmission de l’herpès génital L’une des craintes majeures des patients atteints d’herpès est le risque de contaminer leur partenaire. Le premier des conseils est d’éviter les rapports sexuels au cours des récurrences cliniques jusqu’à cicatrisation complète. Mais nous savons qu’il existe des excrétions virales asymptomatiques (EVA), par définition imprévisibles et non identifiables. Des études ont permis de mieux cerner ce risque de transmission. En premier lieu, la durée des EVA est généralement courte : 24 % durent moins de 6 heures et 49 % durent moins de 12 heures(6). Leur fréquence diminue avec le temps : au-delà de la première année, elle est estimée à 13,1 % du temps chez les sujets symptomatiques et 8,8 % du temps chez les sujets asymptomatiques(7). Ainsi, un sujet porteur d’un herpès génital ne présente aucun risque de contamination dans environ 90 % du temps. Une étude un peu ancienne montre que le risque annuel d’acquisition de l’herpès au sein d’un couple discordant (l’un porteur d’un herpès génital et l’autre pas) est de 9,7 % (3,8 % de contamination masculine et 16,9 % de contamination féminine)(8). Enfin, la transmission virale se fait quel que soit le type de rapport sexuel : génito-génital, ano-génital ou oro-génital. Présentations cliniques Si le tableau clinique classique de la récurrence herpétique typique est bien connu, il faut admettre que nombre de lésions génitales herpétiques échappent au diagnostic en raison de la grande variabilité clinique de cette virose. On estime que plus de 60 % des sujets infectés(3,9) par HSV2 l’ignorent, soit parce qu’ils ne présentent aucune manifestation clinique, soit parce que le diagnostic d’herpès n’a pas été porté devant leurs manifestations cliniques. Cette proportion dépasse 70 % en cas d’infection par HSV1(9). Les variantes cliniques sont en réalité nombreuses : – érosion unique, – érosions disséminées et non groupées en bouquet, – érosions confluentes (ulcérations), – fissures, – simples plages érythémateuses, – épisode d’œdème localisé d’une lèvre vulvaire, – localisation atypique : fissure anale, lésion pubienne, crurale… Toute lésion ano-génitale récidivante devrait faire évoquer le diagnostic d’herpès génital. Devant l’impact psychologique de l’annonce de ce diagnostic et les conséquences psychoaffectives au sein du couple, il est préférable de confirmer le diagnostic par un examen de laboratoire. Herpès et grossesse On sait que la présence d’HSV dans le tractus maternel à proximité de l’accouchement favorise le risque d’herpès néonatal avec un risque faible en cas de récurrence herpétique et un risque beaucoup plus élevé en cas de primo-infection herpétique (2 vs 57 %)(10). Une étude de cohorte portant sur 662 913 couples femme-nouveau-né(11) a également démontré que la survenue de récurrences herpétiques non traitées au cours du 1er et du 2e trimestre de grossesse expose à un risque de prématurité (OR : 2,87) et de rupture prématurée des membranes (OR : 3,57). Chez les patientes enceintes ayant présenté au moins un épisode d’herpès en cours de grossesse, le traitement préventif par valaciclovir 500 mg x 2/j à partir de la 36e semaine d’aménorrhée (SA) réduit significativement les excrétions virales et les épisodes cliniques et ainsi le recours à la césarienne(12). Confirmer le diagnostic Sérologie Elle permet d’identifier les sujets porteurs d’anticorps anti-HSV, c’est-à-dire hébergeant le virus. Seules les sérologies spécifiques différenciant les anticorps antiHSV1 et les anticorps anti-HSV2 ont une chance d’être interprétables. Mais cette interprétation doit tenir compte que 65 à 80 % de la population a rencontré HSV1 pendant l’enfance(2) et sera donc séro-positive HSV1 sans pour autant présenter un herpès génital. Une sérologie HSV1 et HSV2 négative élimine la possibilité d’un herpès, pour peu que la sérologie soit effectuée au moins 3 à 6 semaines après la contamination, le délai de séroconversion pouvant atteindre 3 mois(13). Une sérologie HSV2 positive prouve que le sujet héberge bien le virus, mais ne prouve pas que les lésions constatées sont réellement liées à cette virose. Une sérologie HSV1+ et HSV2 n’élimine pas le risque d’infection herpétique génitale en raison du nombre croissant d’herpès génitaux liés à HSV1. La sérologie est donc relativement inadaptée au diagnostic d’une lésion clinique. Recherche virale Elle est donc préférable à la sérologie. Deux principales techniques sont utilisables : la culture virale et la recherche du génome viral par amplification génique. Seule la culture permet une identification du type de virus (HSV1 ou 2). C’est donc cette dernière technique qui devra être utilisée en cas de lésion génitale(14). Quelle que soit la technique utilisée, la technique de prélèvement conditionne la fiabilité du résultat. L’examen doit être pratiqué dans les 2 ou 3 premiers jours d’une récurrence. Au-delà, les chances d’identifier la présence du virus sont faibles. En cas de délai dépassé, il convient de remettre à la patiente une ordonnance : « Recherche de virus herpétique sur lésion » en recommandant à celle-ci de faire pratiquer l’examen dès le début de la crise suivante. Outre la nécessité d’éviter les faux diagnostics d’herpès génital, confirmer le diagnostic par la biologie permet de définir le type de virus, d’une part pour évaluer les risques évolutifs ultérieurs (HSV1 récidive généralement moins souvent qu’HSV2) et surtout pour évaluer le statut du partenaire sexuel pour gérer la transmission. Cette identification virale permet également de cibler le dépistage d’un éventuel portage chez le partenaire sexuel et ainsi de mieux gérer les méthodes de prévention de la contamination. Traitement Il n’y a aucun traitement définitif de l’infection. Les récurrences herpétiques se traitent par une prise d’antiviral (valaciclovir) pendant 5 jours. La primo-infection nécessite généralement un traitement plus long. La gestion des douleurs de la récurrence ou de la primo-infection bénéficie d’un nouveau gel (Clareva®) composé de triglycérides oxydés qui réduit rapidement les sensations de brûlures et/ou les douleurs. En cas de récidives fréquentes (plus de 6 par an soit plus d’une tous les 2 mois), un traitement suppressif de valaciclovir (500 mg per os tous les jours à heure fixe) peut être prescrit pour une durée de 6 à 12 mois. Ce traitement entraîne une réduction spectaculaire (voire une disparition chez certains patients) des récurrences herpétiques ainsi qu’une diminution des EVA et, bien entendu, du risque de transmission(15,16). Il est utile d’interrompre de temps à autre le traitement pour faire le point sur le rythme actuel des récurrences. En cas de traitement dépassant 1 an, un bilan sanguin des fonctions rénales et hépatiques paraît judicieux. Prévention Au sein du couple La découverte d’un herpès génital au sein d’un couple stable pose deux types de problèmes : l’origine de la contamination et la gestion de la transmission. • Sur le premier point, la prudence est de mise, d’autant que les délais d’apparition de lésions herpétiques après une contamination peuvent se chiffrer en mois (voire années). • La gestion de la transmission au sein de couples discordants (l’un herpès cliniquement et biologiquement démontré, l’autre sans antécédents particuliers) passe nécessairement par la définition du statut du partenaire asymptomatique. La sérologie spécifique joue alors un rôle important. Dans le cas, par exemple, d’une infection à HSV2 reconnue, une sérologie positive chez le partenaire asymptomatique permet de réduire les conseils de prévention à leur plus strict minimum, puisqu’un sujet déjà porteur du HSV2 ne peut pas être « surcontaminé ». En revanche, un partenaire asymptomatique séronégatif pour HSV2 est vulnérable et les mesures de prévention doivent être appliquées. Nous avons vu que le risque de transmission est surtout élevé au cours des premiers mois qui suivent la première manifestation clinique de l’infection (port du préservatif recommandé pendant 6 à 12 mois)(17). Au-delà de ces premiers mois, le risque est proportionnel au nombre de récurrences cliniques : plus un patient récidive cliniquement, plus le nombre d’EVA augmente. Ainsi, le partenaire d’un sujet peu récidivant (quelques récidives annuelles) n’a que peu de risque de contamination en dehors d’une récurrence clinique. En revanche, le risque de contamination est élevé pour les partenaires de sujets très récidivants (plus de 6 par an). Dans ce cas, le traitement suppressif réduit considérablement le risque de contamination. La vaccination Environ une vingtaine de candidats vaccins ont été testés chez l’animal au cours des 5 dernières années : sous-unités virales, vaccins vivants atténués, vaccins réplicatifs, vaccins peptidiques, vaccins à ADN…(18). La voie d’administration pose également débat. Il semble que l’administration muqueuse soit préférable à la voie intramusculaire ou sous-cutanée. Les voies intranasale et orale paraissent les plus efficaces au cours des essais chez l’animal(18). De même, on sait que les adjuvants vaccinaux jouent un rôle capital dans l’efficacité vaccinale. À ce jour, plusieurs adjuvants sont, ou ont été, testés (aluminium, lipide monophosphorylé, toxine cholérique, Heat Shock Protein, peptides synthétiques, agoniste β2-adrénergique, α galactosyd céramide, Vaxfectin®…) avec des résultats très variables. Mais, à l’heure actuelle, les résultats cliniques de nombreux candidats vaccins sont plutôt décevants, surtout en ce qui concerne les vaccins prophylactiques. Récemment, un des candidats vaccins prophylactiques les plus prometteurs, un vaccin sous unité (glycoprotéine Gd2 du virus HSV2) s’est révélé plus protecteur vis-à-vis de HSV1 au niveau génital que vis-à-vis de HSV2 (essai Herpevac® laboratoire GSK)(19), ce qui laisse perplexe le comité scientifique en charge du vaccin sur l’éventuelle poursuite des essais cliniques de ce type de vaccins… En ce qui concerne les vaccins thérapeutiques, un vaccin synthétique (HerpV®, laboratoire Agenus) associant Heat Shock Protein et 32 peptides ainsi qu’un adjuvant original (QS-21 Stimulon®) a montré, dans un essai de phase II vs placebo, une réduction significative des excrétions virales (d’environ 15 %) ainsi qu’une réduction de la charge virale d’environ 75 % (Fierce Vaccines, June 26, 2014). Une autre étude phase I/IIa portant sur un vaccin sous-unité protéinique (GEN 003®, laboratoire Genocea) a montré une réduction importante de l’excrétion virale ainsi que de la fréquence des lésions chez des sujets infectés par HSV2 (présentation orale de A. Wald et coll. lors du World Vaccine Congress, 24-26 mars 2014 Washington, DC). Sanofi en association avec Immune Design Corp cherche à développer une immunothérapie efficace vis-à-vis d’HSV, dont un vaccin Sanofi (vaccin défectif pour la réplication) en cours d’étude phase I chez des sujets infectés et des sujets non infectés. Une étude phase I/II avec un vaccin ADN avec adjuvant Vaxfectin® (laboratoire Vical) débute chez des sujets infectés dans plusieurs états des États-Unis. Au total L’herpès génital est une infection fréquente mais bénigne dans l’immense majorité des cas. Cependant, les conséquences psycho-sexuelles altèrent parfois sérieusement la qualité de vie des sujets atteints. L’utilisation de produit actifs rapidement sur la symptomatologie ainsi que la proposition de traitements suppressifs chez les sujets très récidivants permettent de réduire l’impact délétère de cette infection sur la vie quotidienne de nos patients, en attendant que les premiers résultats prometteurs des vaccins thérapeutiques soient confirmés par les études en cours ou à venir.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :





