Cancérologie
Publié le 02 fév 2015Lecture 6 min
Épigénétique et cancers hormonodépendants : acétylation et signalisation estrogénique dans les cancers du sein
M. LAPIERRE*, A. LINARES*, N. BOULLE*,** et V. CAVAILLES*/*IRCM, Insitut de recherche en cancérologie de Montpellier ; INSERM U896 ; Université Montpellier-1 ; CRLC Val d’Aurelle – Paul-Lamarque, Montpellier/**Laboratoire de biologie cellulaire et hormona
L’acétylation sur lysine est une des modifications épigénétiques majeures, initialement identifiée sur les histones, qui contrôle de nombreux processus cellulaires. Dans les cellules cancéreuses mammaires humaines, cette marque épigénétique permet une régulation relativement complexe de la signalisation estrogénique. Les groupements acétyle sont enlevés par des enzymes appelées histone désacétylases (HDAC) et l’inhibition de ces enzymes conduit à des effets cellulaires extrêmement intéressants. Ainsi, plusieurs inhibiteurs de HDAC sont en cours de développement clinique, en association avec des cytotoxiques ou d’autres thérapies ciblées.
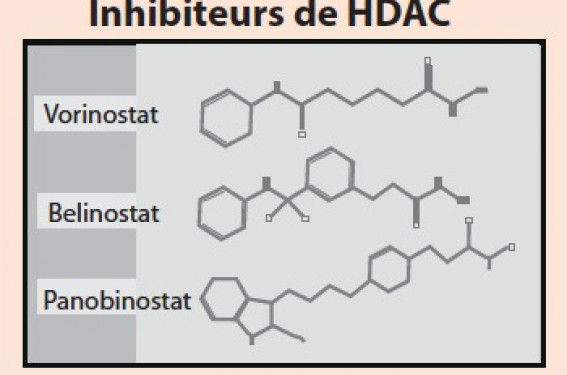
L’acétylation : une marque épigénétique L’acétylation des protéines sur les résidus lysines est une modification post-traductionnelle majeure qui régule un grand nombre de processus importants pour l’homéostasie cellulaire. Initialement identifiée sur les histones dans un processus appelé « code des histones », l’acétylation touche en fait un très grand nombre de protéines, comme le montrent des études récentes mettant en œuvre des approches de protéomique globale(1). L’acétylation est un des leviers épigénétiques qui contrôlent l’expression du génome sans modifier sa séquence, au même titre que la méthylation de l’ADN ou des protéines ou certains ARN non codants. C’est un processus dynamique contrôlé par des acétylases (HAT) et des désacétylases (HDAC) qui, respective ment, déposent et enlèvent les groupes acétyle (figure). Au niveau de la chromatine, les histones acétylées sont reconnues spécifiquement par des protéines contenant un motif bromodomaine qui participe à la lecture du code des histones. HDAC et inhibiteurs de HDAC comme agents thérapeutiques Chez l’homme, 18 HDAC ont été identifiées et classées en quatre familles selon leur degré d’homologie de séquences et la nature de leur domaine catalytique utilisant le zinc ou le NAD comme cofacteur(2). Les HDAC sont impliquées dans des mécanismes cellulaires généraux tels que la prolifération cellulaire ou l’apoptose, mais également dans la différenciation de tissus spécifiques (cœur, muscle squelettique ou cerveau), notamment pour les HDAC de classe II. Les premiers inhibiteurs de HDAC ciblant le domaine catalytique zinc-dépendant ont été développés dès les années 1970. Très rapidement, leur intérêt en tant qu’agents antitumoraux a été mis en évidence dans les tumeurs hématologiques et solides, conduisant à développer de nouveaux inhibiteurs de structure et d’efficacité variées (figure). À ce jour, une centaine d’essais cliniques utilisant ces molécules, seules ou en association avec d’autres traitements (chimiothérapies ou thérapies ciblées), sont en cours dans le domaine du cancer(3,4). Acétylation des lysines et inhibiteurs de HDAC. Signalisation par les estrogènes et cancer du sein Les estrogènes exercent un rôle clé dans la physiologie et la cancérogenèse mammaires(5). Ils agissent par liaison à des récepteurs spécifiques appartenant à la famille des récepteurs nucléaires, les récepteurs des estrogènes (REα et REβ). Environ 70 à 80 % des cancers du sein infiltrants expriment le récepteur des estrogènes REα, ce qui a permis la mise en place de traitements visant à bloquer la signalisation estrogénique. Cependant, ces thérapies sont limitées par des phénomènes de résistance apparaissant d’emblée ou acquises au cours du traitement. Au niveau moléculaire, la liaison de l’hormone aux RE induit une modification conformationnelle, entraînant leur fixation sur des promoteurs de gènes estrogénosensibles et le recrutement de complexes multiprotéiques comprenant des HAT ou des HDAC. Ces enzymes participent activement à la régulation des gènes cibles en modifiant la chromatine au niveau des promoteurs correspondants. Acétylation et signalisation estrogénique L’effet des estrogènes sur la structure de la chromatine est connu depuis plusieurs décennies et des études récentes mettent également en lumière un lien entre environnement (xéno-estrogènes) et modifications épigénétiques. Dans un modèle de tumorigenèse mammaire chez le rat, l’effet oncogénique des estrogènes est associé à différentes modifications épigénétiques (méthylation de l’ADN, expression de microARNs et modifications des histones)(6). Par ailleurs, plusieurs études ont montré que de nombreux acteurs de la signalisation par les estrogènes sont des protéines acétylées, ce qui illustre la complexité des effets pouvant résulter de la modulation du niveau d’acétylation en réponse à l’inhibition des HDAC(7,8). Cette modification post-traductionnelle contrôle différents paramètres tels que la stabilité et la localisation subcellulaire de la protéine. De manière intéressante, les HDAC et leurs inhibiteurs régulent de manière très complexe la signalisation par les estrogènes dans les cellules de cancer du sein. Dans les lignées cellulaires mammaires humaines exprimant le REα, l’inhibition des HDAC conduit à une diminution très marquée de l’expression du REα au niveau de l’ARNm et de la protéine. Les mécanismes impliqués sont variés et font intervenir à la fois des régulations transcriptionnelles (rôle des HDAC5 et 9 sur le facteur de transcription MEF2) et post-traductionnelles (acétylation de la protéine chaperonne Hsp90). Inhibiteurs de HDAC et réponse aux antiestrogènes Les inhibiteurs de HDAC sont capables de potentialiser ou de restaurer la réponse antiproliférative de cellules cancéreuses mammaires au tamoxifène ou aux inhibiteurs de l’aromatase. Bien que cela reste débattu à l’heure actuelle, plusieurs articles ont également montré que le traitement par des inhibiteurs de HDAC permettait la réexpression du REα et, dans certains cas, la restauration de la sensibilité au tamoxifène de lignées cellulaires humaines mammaires REα négatives. Plusieurs essais cliniques utilisant des inhibiteurs de HDAC en combinaison avec des thérapies hormonales (tamoxifène, fulvestrant ou inhibiteurs de l’aromatase) ont été réalisés ou sont actuellement en cours(9). Conclusions et perspectives L’analyse des liens entre les HDAC et les RE met en évidence des niveaux d’interaction multiples etcomplexes. Plusieurs questions importantes restent à résoudre afin de mieux apprécier le rôle exact des HDAC dans les tumeurs du sein résistantes aux thérapies hormonales. Les inhibiteurs des HDAC ont conduit à des premiers résultats intéressants dans le traitement des cancers du sein avancés. Cependant, l’identification d’inhibiteurs plus spécifiques permettra peut-être d’augmenter l’efficacité des traitements et de réduire leur toxicité. En outre, des études complémentaires seront nécessaires afin de définir les meilleures combinaisons thérapeutiques ainsi que les biomarqueurs permettant d’identifier les patientes qui bénéficieront de ces nouvelles thérapies combinatoires.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :